微生物学
組織紹介
医学専攻 病態制御医学系:微生物学講座の概要
構成員の紹介
| 教授 | 海老原 敬 | Takashi EBIHARA |
|---|---|---|
| 助教 | 高須賀 俊輔 | Shunsuke TAKASUGA |
| 助教 | 立松 恵 | Megumi TATEMATSU |
| 技術職員 | 渕向 茜 | Akane FUCHIMUKAI |
教育と研究の概要
主な担当授業
主な担当授業:
学部学生
講義:「生体と微生物」
実習:「感染症・生体防御学実習」
大学院学生
担当講義・実習:
「細胞・人体の形態と機能」「先端的細胞培養技術」「分子生物学持論」「遺伝子組み換え技術」(修士)
「医科学研究セミナー」「基礎医学技術実習」「細胞生物学・実習」(博士)
主な研究対象
1、感染症・疾患感受性決定因子としての初期免疫応答
2、自然リンパ球の分化・機能制御機構
3、各種疾患モデル(慢性閉塞性肺疾患・喘息等)における転写因子の機能解析
医学専攻 病態制御医学系:微生物学講座の概要
同じ風邪にかかっても、酷い症状を呈する人もいれば、熱すら出さない人もいます。同じアレルゲンに暴露していても、アレルギー症状を出す人もいれば、そうでない人もいます。喫煙する人も、慢性気管支炎や肺がんになる人がいる一方で、結構元気な人も存在します。おそらくは、初期の免疫応答に何らかの違いがあるのではないか?そういった仮説をもって、研究を行っています。
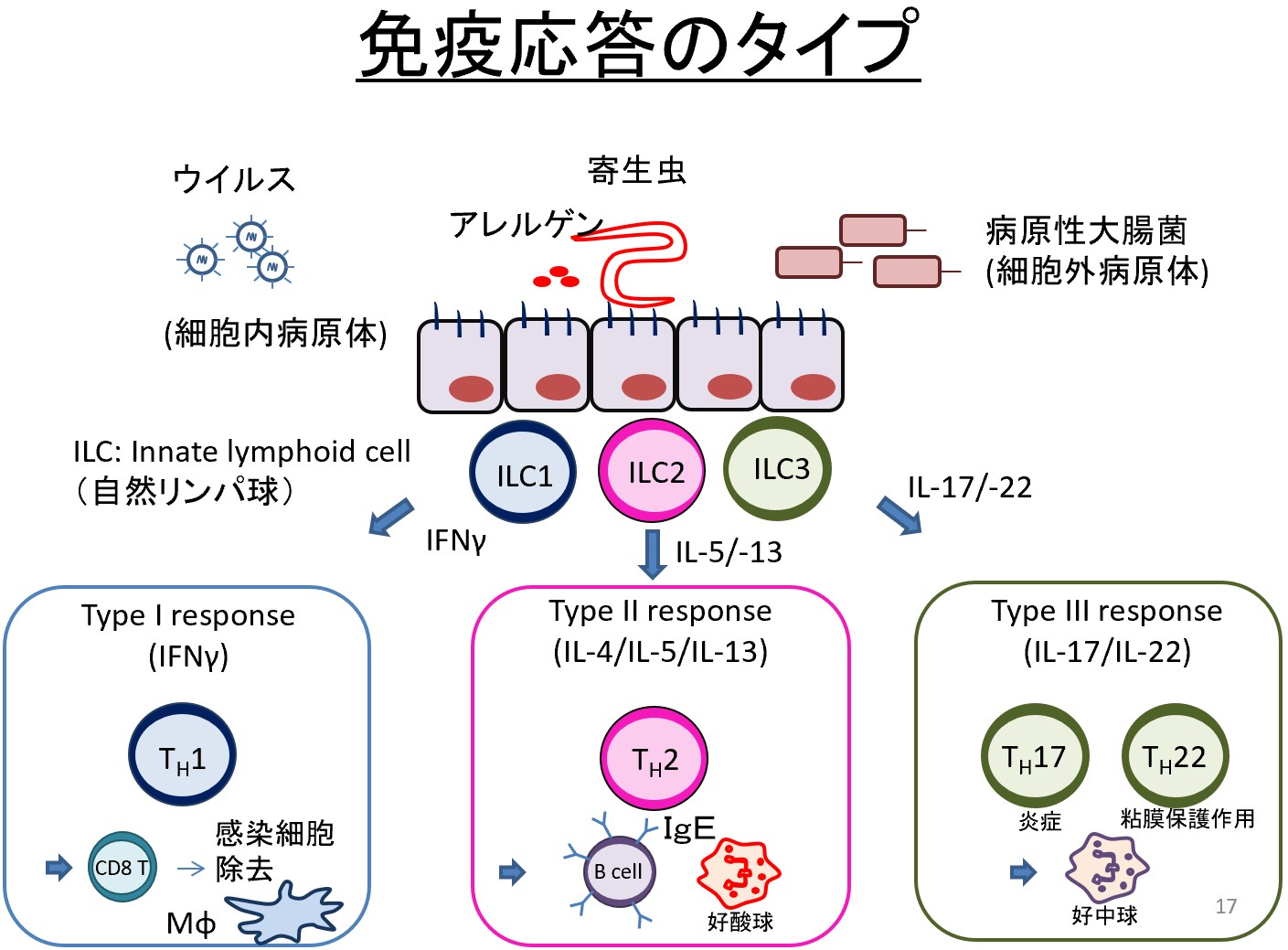
特に、現在は、初期免疫担当細胞の中で、自然リンパ球という細胞に着目しています。自然リンパ球は、2010年頃に初めて報告された細胞群で、様々な疾患の増悪や軽快に関与し、ヒトの健康維持に重要な機能を果たすことが分かってきました。自然リンパ球は、組織粘膜に常在し、初期のヘルパーサイトカインを産生することにより、その後の免疫応答の方向性を決定します。したがって、自然リンパ球の研究によって、感染症・疾患感受性のコントロールができるようになるのではないかと考えています(上図)。
例えば、2型自然リンパ球(ILC2)は、肺に常在し、アレルゲンが気道に侵入してきた際に、増殖・活性化し、IL-5やIL-13のようなサイトカインを産生することによりアレルギー炎症を誘導します。ILC2は、試験管内培養すると活性化したまま、半永久的に増え続けるので、今までILC2が活性化により細胞死に至るとは考えられていませんでした。そこで、マウスに慢性アレルギー炎症を起こし、活性化したILC2を詳しく調べました。
結果、1) 活性化しすぎたILC2は疲弊して活性が低下すること(疲弊様ILC2)、2) 疲弊する際、TIGITという抑制性の膜分子受容体を発現すること、3) ILC2の近くにいるマクロファージ(食細胞)がTIGITのリガンドであるCD155を発現し、TIGIT陽性ILC2に細胞死を誘導すること、4) TIGIT陽性ILC2の細胞死を阻害すると、慢性気道アレルギー炎症が増悪すること、が分かりました。以上より、過剰に活性化したILC2が生体から除去されることは、過剰な炎症を抑制するための大事な生体防御システムであることが分かりました。このような現象は、初めて発見された慢性アレルギー抑制機序であり、私達は、この細胞死をILC2のActivation-induced cell death: AICD(活性化による細胞死)と名付けました(参考文献3、5)。
以上、慢性アレルギー炎症における自然リンパ球の機能をご紹介しましたが、ILC2以外の自然リンパ球として、抗ウイルス・腫瘍免疫を担当するILC1やNK細胞、消化管粘膜免疫を担当するILC3の研究も行っております。当講座に興味をお持ちの方は、気軽にご連絡ください。また、修士の学生、大学院生、研究生は、常に大歓迎です。TEL 018-884-6080/6079, e-mail: tebihara@med.akita-u.ac.jp (海老原 敬)まで。
1) Yamagata K, Takasuga S, Tatematsu M, Fuchimukai A, Yamada T, Mizuno M, Morii M, Ebihara T. FoxD1 expression identifies a distinct subset of hepatic stellate cells involved in liver fibrosis. Biochem Biophys Res Commun 734:150632. 2024. doi: 10.1016/j.bbrc.2024.150632.
2) Okuyama K, Yamashita M, Koumoundourou A, Wiegreffe C, Ohno-Oishi M, Murphy SJH, Zhao A, Yoshida H, Ebihara T, Satoh-Takayama N, Kojo S, Ohno H, Morio T, Wu Y, Puck J, Xue H, Britsch S, Taniuchi I. A mutant BCL11B-N440K protein interferes with BCL11A function during T lymphocyte and neuronal development. Nat Immunol. 2024. doi: 10.1038/s41590-024-01997-5.
3) Ebihara T*, Yamada T, Fuchimukai A, Takasuga S, Endo T, Yamada Y, Tatematsu M. Dysfunction of type 1 and type 2 immune cells: a lesson from exhausted-like ILC2s and their activation-induced cell death. Int Immunol. 2024. https://doi.org/10.1093/intimm/dxae032
4) Cui G, Shimba A, Jin J, Hojo N, Asahi T, Abe S, Ejima A, Okada S, Ohira K, Kato R, Tani-ichi S, Yamada R, Ebihara T, Shiroguchi K, and Ikuta K. CD45 alleviates airway inflammation and lung fibrosis by limiting expansion and activation of ILC2s. Proc. Natl. Acad. Sci. USA., 120: e2215941120. 2023
5) Yamada T, Tatematsu M, Takasuga S, Fuchimukai A, Yamagata K, Seki S, Kuba K, Yoshida H, Taniuchi I, Bernhardt G, Shibuya K, Shibuya A, Yamada T, Ebihara T*. TIGIT mediates activation-induced cell death of ILC2s during chronic airway allergy. J Exp Med. 220(7):e20222005. 2023.
6) An J, Nagaki Y, Motoyama S, Kuze Y, Hoshizaki M, Kemuriyama K, Yamaguchi T, Ebihara T, Minamiya Y, Suzuki Y, Imai Y, Kuba K. Identification of Galectin-7 as a crucial metastatic enhancer of squamous cell carcinoma associated with immunosuppression. Oncogene. 41(50):5319-5330. 2022.
7) Miyabe Y, Tomizawa H, Saito H, Yamada T, Shiina K, Koizumi K, Kawasaki Y, Suzuki S, Fukuchi M, Ueki S, Ebihara T, Yamada T. Quantification of Aspergillus fumigatus antigen Asp f 1 in airway tissue and allergic inflammation. Allergy. 77(10):3154-3156. 2022.
8) Ebihara T*, et., al., Trained innate lymphoid cells in allergic diseases. Allergol Int. (20)30151-9. 2021.
9) Ebihara T*. Dichotomous Regulation of Acquired Immunity by Innate Lymphoid Cells. Cells. 9(5):1193. 2020.
10) Ebihara T*, Taniuchi I. Exhausted-like Group 2 Innate Lymphoid Cells in Chronic Allergic Inflammation. Trends Immunol. 40:1095-1104. 2019.
11) Ardain A, Ebihara T, Khader SA, et al., Group 3 innate lymphoid cells mediate early protective immunity against tuberculosis. Nature. 570:528-532. 2019.
12) Ebihara T* and Taniuchi I. Transcription Factors in the Development and Function of Group 2 Innate Lymphoid Cells. Int J Mol Sci. 20: pii: E1377. 2019.
13) Miyamoto C, Ebihara T*, et al., Runx/Cbfβ complexes protect group 2 innate lymphoid cells from exhausted-like hyporesponsiveness during allergic airway inflammation. Nat Commun. 10:447. 2019.
14) Tenno M, Ebihara T, Taniuchi I, et al. Cbfβ2 controls differentiation of and confers homing capacity to prethymic progenitors. J Exp Med. 215:595-610. 2018.
15) Bern MD, Ebihara T, Yokoyama WM, et al., Immunoreceptor tyrosine-based inhibitory motif-dependent functions of an MHC class I-specific NK cell receptor. Proc Natl Acad Sci U S A. pii: 201713064. 2017.
16) Ebihara T, Seo W, Taniuchi I. Roles of RUNX Complexes in Immune Cell Development. Adv Exp Med Biol. 962:395-413. 2017.
17) Ebihara T, Yokoyama WM, et al., Runx3 specifies lineage commitment of innate lymphoid cells. Nat Immunol. 16:1124-33, 2015.
18) Ebihara T, Jonsson AH, and Yokoyama WM. NK Cell Licensing in Mice with Inducible Expression of MHC Class I. Proc Natl Acad Sci U S A. 110:E4232-7. 2013.
19) Ebihara T, Seya T, et al., Identification of a polyI:C-inducible membrane protein that participates in dendritic cell-mediated natural killer cell activation. J Exp Med. 207:2675-87. 2010.
20) Ebihara T, Seya T, et al., Hepatitis C virus (HCV)-infected apoptotic cells extrinsically modulate dendritic cell function to activate T cells and NK cells. Hepatology. 48:48-58. 2008.
21) Ebihara T, Seya T, et al., NKG2D ligands are induced on human dendritic cells by TLR ligand stimulation and RNA virus infection. Int Immunol. 19:1145-55. 2007.
22) Ebihara T, Endo R, Ma X, Ishiguro N, Kikuta H. Lack of association between New Haven coronavirus and Kawasaki disease. J Infect Dis. 192:351-2. 2005.
23) Ebihara T, Endo R, Ma X, Ishiguro N, Kikuta H. Detection of human coronavirus NL63 in young children with bronchiolitis. J Med Virol. 75:463-5. 2005.
24) Ebihara T, Kikuta H, Ishiguro N, Kobayashi K, et al., Human metapneumovirus infection in Japanese children. J Clin Microbiol. 42:126-32. 2004.
25) Ebihara T, Kikuta H, Ishiguro N, Kobayashi K, et al., Seroprevalence of human metapneumovirus in Japan. J Med Virol. 70:281-3. 2003.